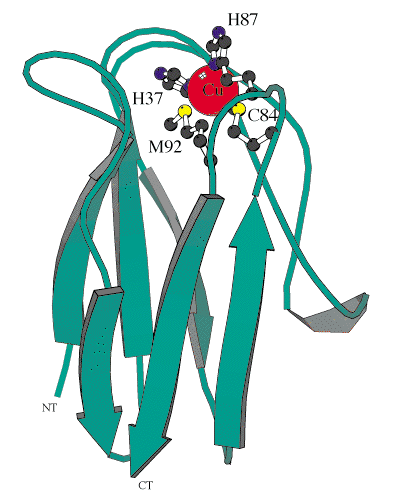
1) "Ultrafast Anisotropy Measurements
on Charge Transfer Dynamics in Plastocyanin." Satoru
Nakashima, Kazushige Seike, Yutaka Nagasawa, Tadashi Okada, Maki, Sato
and Takamitsu Kohzuma, J. Chinese Chem. Soc., 47, 693-697, 2000.
2) "Coherent dynamics
in ultrafast charge-transfer reaction of plastocyanin." Satoru
Nakashima, Yutaka Nagasawa, Kazushige Seike, Tadashi Okada, Maki, Sato
and Takamitsu Kohzuma, Chem. Phys. Lett., 331, 396-402, 2000.
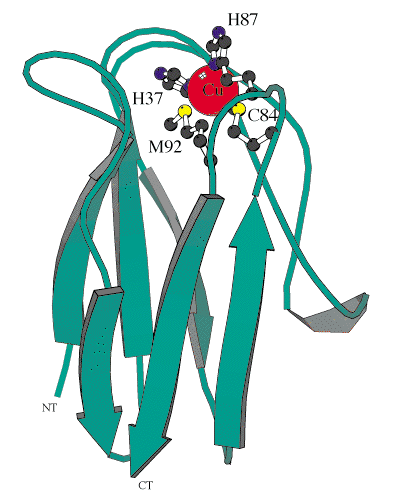
蛋白質における電子移動反応ではその揺らぎを巧みに利用して効率的な反応を行っていると考えられている。しかし通常の生理条件下の反応ではそうした揺らぎは平均化されてしまい散逸的な緩和過程だけが観測されるため、どのような蛋白質のモードが鍵を握っているか調べることは困難である。超高速レーザ励起を用いた反応の追跡では系のコヒーレントなモードを励起できるため、こうした反応に関与して重要な非散逸的なモードを観測できる可能性がある。本研究では光合成系などで電子移動反応に関与することが知られているブルー銅蛋白質のプラストシアニンを用いて、自家製の30
fsのパルス幅を持つレーザでの励起による電子移動反応の緩和過程を測定した。ここで、蛋白質骨格振動由来のコヒーレントな振動モードが観測され、かつこのモードは反応と強く結合していることを明らかにした。この結果は、化学反応にコヒーレントなモードが関与していることを示した点と、蛋白質中の低振動モードが反応に強く結合していることを示した点で非常に画期的であると考えられる。
プラストシアニンは、光化学系IIのCytochrome b6-f 複合体から光化学系Ιへ電子伝達をする2価のブルー銅蛋白質である。活性部位には、銅(II)イオンとそれに配位結合している4つのアミノ酸残基があり、そのうち2つはシステインとメチオニンのS原子で、残り2つはヒスチジンのN原子である。(図1)この活性部位は電子移動の反応場であり、生理条件下の電子移動は銅イオンからシステインのS原子を経由して引き起こされていることが解っている。構造はひずんだ4面体構造をしており、通常の銅(II)錯体と比較すると異常な構造をしている。これは蛋白質の骨格によって構造が強制的にねじ曲げられていることを意味し、このためシステインのS原子と銅イオンとの間に比較的強い共有結合性が増す。この強い共有結合性により、配位子−金属電荷移動(LMCT)による大きな吸収帯が
600 nm 付近にあらわれる。この電荷移動はS配位子と銅イオンの結合を通して起こるので、レーザ励起によるLMCT状態から基底状態へ緩和する過程を調べることにより、蛋白質のダイナミクスを伴う電子移動機構について知見を得ることができると考えた。具体的にはこのプラストシアニンの超高速電荷移動緩和過程を、自作のキャビティダンプしたパルス幅30fsのCr:Forsteriteレーザーを用いてプラストシアニンのLMCT帯を励起し超高速ポンプ・プローブ測定を行うことで、蛋白質のダイナミクスによって引き起こされるコヒーレントな振動と電子移動のポピュレーション・ダイナミクスを観察することで調べた。
プラストシアニンは定法にしたがいmutationにより大腸菌に発現させたものを精製して用いた。サンプルの濃度はリン酸緩衝溶液を用いて3.9mMに調整した。これで635
nmにおける吸光度は1mmセルで1.43になった。キャビティーダンプしたCr:Forsteriteレーザーの第二高調波の出力は、中心波長635
nm、繰り返し周波数50 kHzであり、これをポンプ光とプローブ光に分けた。パルスのエネルギーは、ポンプ光プローブ光それぞれ600pJと50pJである。2本の光線の偏光面の関係はmagic
angleにした。プローブ光は光学遅延距離に通し、サンプルにはポンプ光、プローブ光とも焦点距離 5 cmのレンズを用いて集光した。サンプル点でのパルスの半値幅は、自己相関関数測定により約30
fsと求められた。サンプルは自作の回転セルに封入して測定に用いた。このセルは円板構造をしており、サンプルの光路長は1 mmである。このサンプルを、直径
25 mm、厚さ1 mmの2枚の石英板で挟んだ。サンプルが光によって壊れるのを避けるために、この回転セルを2000rpmで回転させた。プローブ光は(1)全波長をそのまま直接入射する場合と(2)分光器を通し波長分解した場合とで、それぞれSiフォト・ダイオードで検出し、その強度変化をロックイン・アンプにより増幅した。


図2 (a) プラストシアニンのポンププローブ信号とそのフィッティング結果、残差。(b)対数表示すると指数関数減衰していないのがよくわかる。(c) フィッティング結果を成分ごとに分解したもの。
まず、室温におけるプラストシアニンのポンプ・プローブ測定の実測結果とモデル関数を仮定してフィッティングを行った結果を図2に示す。コヒーレントに励起されたラマンモードによる振動と励起状態から基底状態への緩和過程が観測されている。(b)に示したシグナル強度の対数表示から解るように、シグナルは急速に減衰しており、その曲率が正になっているので単なる指数関数成分の和でフィッティングすることはできない。この信号を再現するのに3つのモデル関数を試してみた。(1)2成分指数減衰関数(riseとdecay)、(2)Gauss関数、(3)急速にダンプする低振動指数減衰関数である。その結果、(1)および(2)ではうまく実験結果を再現できなかったが、(3)ではよく一致させることができた。これらの物理的な意味はそれぞれ、(1)散逸的な緩和過程、(2)慣性応答による緩和、(3)コヒーレントな振動モードである。つまり、一般的に溶液系でしばしば観測される、散逸的な緩和過程や慣性応答による緩和ではないようなモードが観測されたことになる。この振動モードは33cm-1の振動数をもち、約360fsで減衰するような振動である。しかも位相が他のラマンモードと比較して120度ほどずれている。基底状態への緩和を指数関数的であると仮定すると、約270fsであった。
また、この指数関数を差し引いたものをフーリエ変換したものを図3に示す。ここで 比較のために(a) には607nm励起で測定した共鳴ラマンスペクトルを載せる。200cm-1以上の振動領域が見事に一致している様子がわかる。プラストシアニンなどブルー銅蛋白質の共鳴ラマンスペクトルについてはその電子状態の詳細とあわせて、詳しく研究されている。それによると、300cm-1から450cm-1付近のモードは銅とシステインのSとの伸縮振動にシステインの変角振動が混ざり合っていくつかに分裂したものであると同定されており、260cm-1付近のモードは銅とヒスチジンのNの間の伸縮振動に帰属されている。プラストシアニンでは活性中心周りは比較的単純な構造をしており、上記の同定された振動モード以外で活性中心に局在化したモードはないと考えられる。実際今回測定されたポンププローブ信号でもこの近辺のモードがよく再現されていることから、今回観測された高波数モードはラマン過程によるもので、こうした活性中心に局在化したモードは反応とはさほど強く結合していないと考えられる。

ここで低振動の33cm-1のモードの由来について考えてみる。上記のようにこれは活性中心に局在化したモードではない。また振動数からもある程度広い範囲に非局在化したモードであると考えられる。共鳴ラマンの励起プロファイルの実験からこのLMCTバンドに関して、銅中心から少なくとも20Å離れたところの残基の構造の違いが強く結合していることが示唆されている。また、分子動力学計算によるシミュレーションからもこの遷移と生理条件下での電子移動経路上の蛋白質の振動モードが強く結合していることが示されている。これらの点を考慮するとこのモードは蛋白質の骨格振動と考えることがもっとも妥当であると言える。現在まで、いくつかの蛋白質でこうしたコヒーレントなモードが見いだされてきているが、いずれもポルフィリンや、ロドプシンと言った発色団のモードであり、蛋白質自体が反応と結合してコヒーレントに振動することを見いだしたのはこれが世界で初めてである。
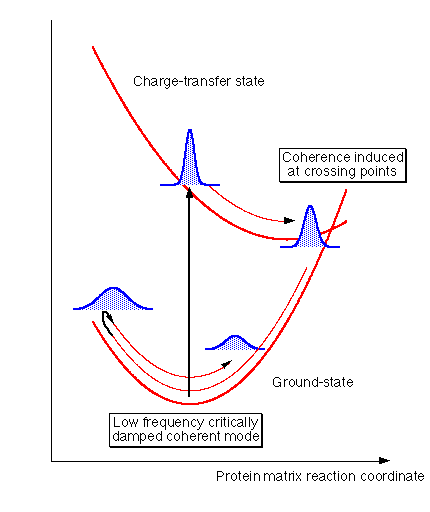
ここで、なぜこうしたコヒーレントなモードが現れたのか考察してみる。通常、溶液などランダムな系での化学反応では絶対反応速度論が示すように反応系と活性錯合体は平衡状態にあり、生成系への緩和は散逸的になる。別の言い方をすれば反応系から活性化状態への励起は溶媒のゆらぎなどランダムな過程を通じて起こり確率論的である。この様な過程の場合、緩和は指数関数的な振る舞いをする。今回観測されたプラストシアニンでの電子移動反応でコヒーレントなモードが観測されたと言うことはこうした仮定が成り立っていないことを示す。光励起によって作られた励起状態のポテンシャル上での振動コヒーレンスは、通常であれば反応の交差点に至るまでに様々な揺動を受けてそのコヒーレンスを失うのであるが、この系の場合図4に示すように、コヒーレンスを保ったまま反応点までに至る。ここでこの振動モード、あるいは横軸にとった蛋白質の骨格振動による反応座標が、反応と非常に強く結合してるならば、励起状態(電荷移動状態)から基底状態(電荷が再結合した状態)へ至る過程でコヒーレンシーが保たれていてもよい。従って基底状態でもこのモードのコヒーレンスが観測されるてもよい。実際、この低振動モードの位相は他のラマン過程による振動モードと異なり、位相が120度シフトしており、こうした、反応によって誘起されたようなコヒーレンスであることを示している。また、波長分解を行った測定では、長波長側、つまり反応点に近いところで観測するとその寿命が短くなることが明らかになっており上記の描像と矛盾しない。
今回の実験結果は蛋白質がその反応を促進させるような特定のモードを持っていることを初めて実験的に明らかに点で、非常に画期的であると考えられる。またこうした振動のコヒーレンスが化学反応に伴って観測されたことも初めてであり、反応論の基礎過程の解明にも重要な示唆を与えるものである。
われわれはこうした結果を踏まえ、さらに詳細を明らかにし今回提唱しているモデルを確実にするため、今後蛋白質の構造変化や温度変化、あるいは励起波長依存性などの実験を進めていく予定である。