研究内容
現代の私たちの生活は有機化合物が無くしては成り立ちません。医薬品、繊維素材、プラスチック製品など、有機化合物はいろいろな形で様々な身近な場所で使われています。このような有機化合物は、分子あるいはその集合体の構造によって多様な機能を発現するため、望みの機能や性質をもつ有機化合物を分子レベルで自在にかつ精密に合成する手法の開発は非常に重要です。
新谷研究室では、とくに
- 「反応をデザインする:新しい選択的有機合成反応の開発」
- 「分子をデザインする:新しい有機化合物の創成」
- 「機能をデザインする:新しい有機化合物の機能開拓」
を3つの柱とした次世代を切り拓く先端研究を通じて、物質科学の発展、さらには人類のより良い生活に貢献すべく研究に取り組んでいます。
1. 縫合反応の開発による新規機能性π共役化合物の創成
ケイ素で架橋されたπ共役化合物はその電子的・光学的性質から機能性有機分子材料としての応用が期待され、幅広く研究されている。しかし、既存の合成手法では構築できる分子骨格が限られており、新しい機能の発現にはより広範なケイ素架橋π共役化合物へのアクセスを可能とする有機合成法の開発が必要である。当研究室では従来法とは異なる合成戦略により、これまでにない分子骨格から成るケイ素架橋π共役化合物の効率的合成に取り組んでいる。
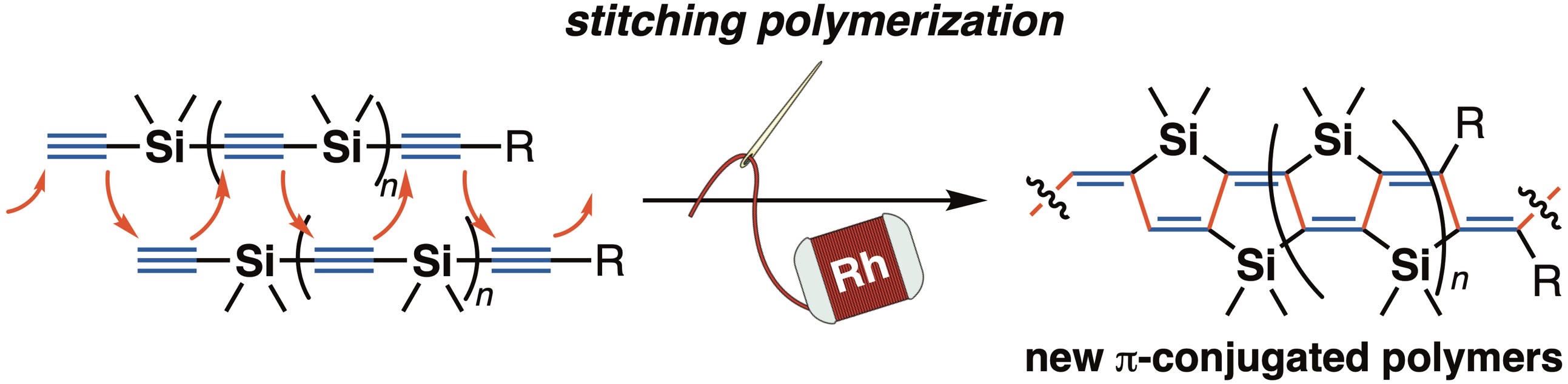
新しい合成戦略として、2つの鎖状分子間を遷移金属触媒によって縫い合わせるように複数の炭素-炭素結合を一挙に構築し架橋型π共役化合物を合成する「縫合反応」を考案し、これまでに最長で6つのケイ素で架橋されたハシゴ型π共役分子の合成に成功している[1,2]。また、この骨格を持つ化合物は、共役長が伸長しても空気下において非常に安定であり、ナノテクノロジーの発展への貢献が期待される単分子トランジスタの有機分子素子として機能することも見出している[3]。
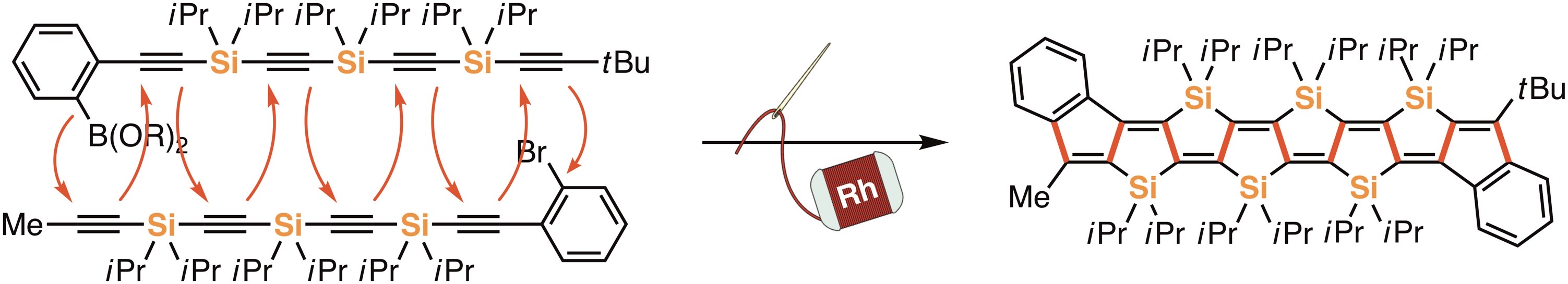
最近の発表論文
- Shintani, R.; Iino, R.; Nozaki, K. J. Am. Chem. Soc. 2016, 138, 3635.
- Shintani, R.; Misawa, N.; Tsuda, T.; Iino, R.; Fujii, M.; Yamashita, K.; Nozaki, K. J. Am. Chem. Soc. 2017, 139, 3861.
- Lee, S. J.; Kim, J.; Tsuda, T.; Takano, R.; Shintani, R.; Nozaki, K.; Majima, Y. Appl. Phys. Express 2019, 12, 125007.
2. 新たな分子変換経路の開拓による含ケイ素機能性有機化合物の創成
ケイ素を含む有機化合物、有機ケイ素化合物は、天然には存在しないが、有機合成における中間体としてばかりでなく、生理活性物質や機能性有機材料などとして有用であり、注目を集めている化合物群である。しかしながら、従来の合成法ではアクセス可能な分子骨格が限られており、有機ケイ素化合物のさらなる機能開拓のためには新たな分子変換反応の開発が必要である。当研究室では特に、適切な遷移金属触媒の利用によって不活性な炭素ー水素結合を切断しながら複雑な有機分子の骨格を一挙に形成する新しい分子変換経路を開拓することで、これまで合成が困難であった様々な有機ケイ素化合物の創出とそれらの光学的・電子的性質の調査による機能発現に取り組んでいる。
例えば、アルキン部位とトリフラート部位をもつ調製容易な化合物から、パラジウム触媒を用いたシンプルな反応条件によって、発光素子として利用可能なベンゾフェナントロシリン類を高効率で得ることに成功しており[1]、また、触媒系を少し変えるだけで、類似の原料から異なる反応経路を通って新たな結合形成反応が起こり、新規化合物群であるベンゾフルオレノシレピンが高選択的に得られることも見出している[2]。また、これらの触媒反応の機構解明に関する研究およびその知見に基づく新たな反応開発による有用化合物の創出についても研究を進めている。
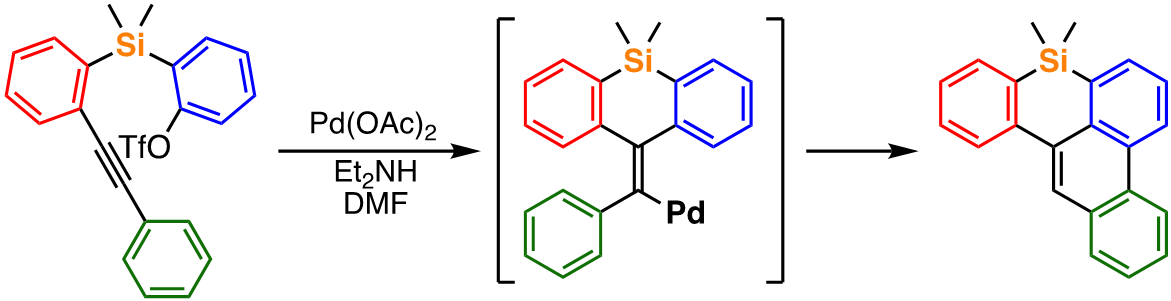
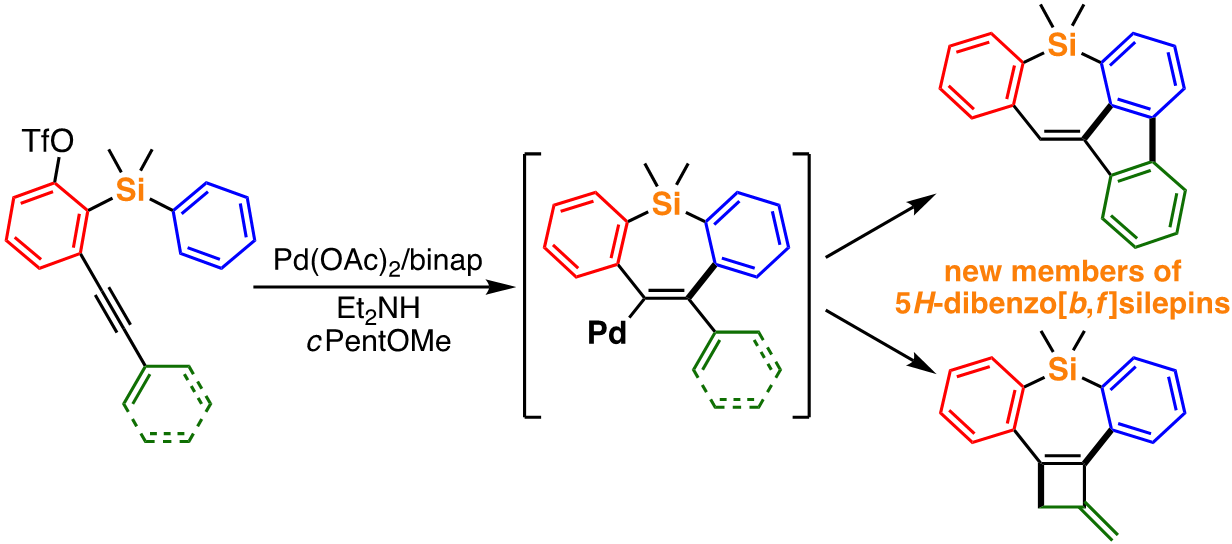
最近の発表論文
- Tsuda, T.; Kawakami, Y.; Choi, S.-M.; Shintani, R. Angew. Chem., Int. Ed. 2020, 59, 8057.
- Tsuda, T.; Choi, S.-M.; Shintani, R. J. Am. Chem. Soc. 2021, 143, 1641.
3. 新規連鎖重合反応による新しい高分子化合物合成
遷移金属錯体を触媒に用いた有機合成反応は現代有機合成化学には不可欠なツールとして定着しており、高分子化合物の合成においても例外ではない。用いる触媒金属及び配位子によって特有の反応性を示すことが低分子化合物の精密有機合成において盛んに研究されており、これらの特徴を高分子合成へとうまく展開することができれば、既存の方法ではアクセス困難な新しい物性を発現しうる高分子化合物の効率的合成が可能になると考えられる。このような観点から当研究室では、遷移金属触媒の特徴を生かした新しい形式による重合反応の開発に取り組んでいる。
例えば、有機ロジウム種への炭素-炭素不飽和結合の挿入を経る触媒反応は強力な有機合成ツールの一つとして用いられているが、有機ロジウム種はまた、分子内で1,4-転位を起こして新たな有機ロジウム種を与えることも知られており、このプロセスを利用した有機合成反応も開発されている。しかしながら、この特徴的な有機ロジウムの性質を重合反応に用いて高分子合成に展開した例はこれまでになかった。そこで当研究室では、ロジウム触媒による「アルケン挿入/1,4-ロジウム転位」の繰り返しによる新しい形式での重合反応の開発を行い、3,3-ジアリールシクロプロペンをモノマーとすることで、新しい主鎖骨格を持つ高分子化合物ポリ(シクロプロピレン-o-フェニレン)を高選択的に合成することに成功している[1]。また、独自に開発した縫合反応を用いた新しい重合プロセス「縫合重合」による、従来法では合成できない新規π共役ポリマーの効率的合成およびその物性評価にも成果を挙げている[2,3]。
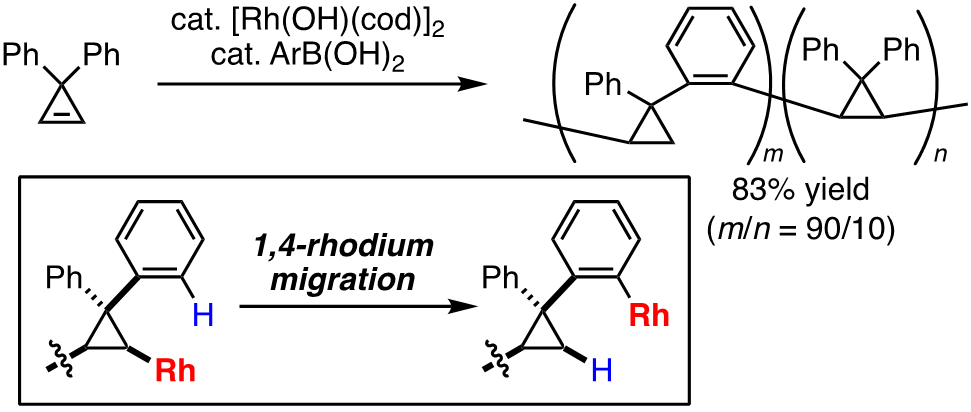
最近の発表論文
- Shintani, R.; Iino, R.; Nozaki, K. J. Am. Chem. Soc. 2014, 136, 7849.
- Ikeda, S.; Shintani, R. Angew. Chem., Int. Ed. 2019, 58, 5734.
- Ikeda, S.; Hanamura, Y.; Tada, H.; Shintani, R. J. Am. Chem. Soc. 2021, 143, 19559.
4. 開殻性を有するπ共役双性イオンの創成
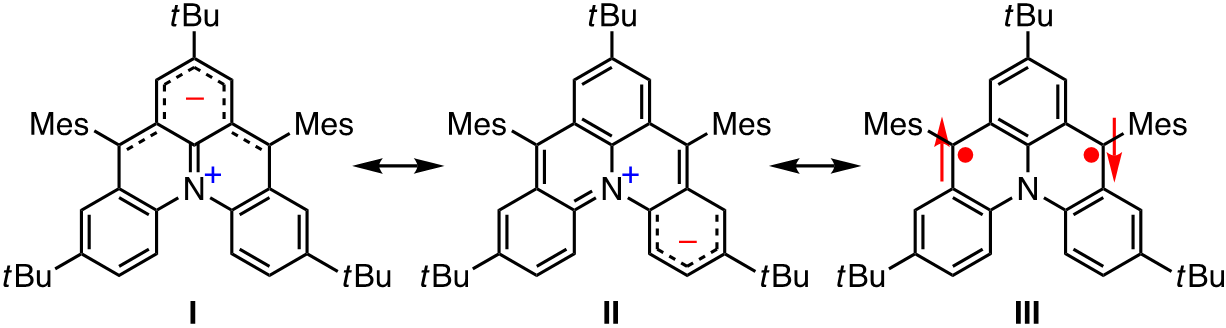
開殻性を有するπ共役分子は、小さなHOMO–LUMOエネルギー差に起因する長波長領域の光吸収や両性の酸化還元特性だけでなく、開殻の電子状態に起因する光学的および磁気的特性など、閉殻のπ共役分子には見られない様々な物性を有することから、近年盛んに研究されている。従来の開殻性π共役分子の多くはo-およびp-キノジメタン構造を有する縮環π共役分子であり、キノイド構造とビラジカル構造の共鳴混成体として記述される。一方、双性イオンとビラジカル構造の共鳴混成体として記述される開殻性π共役分子は研究例が非常に少なく、電子状態や物性が十分に解明されていない。このような研究背景を踏まえ、当研究室では、開殻性を有するπ共役双性イオンの創出に取り組んでいる。
例えば、当研究室で設計・合成した13b-azoniadibenzo[a,j]phenalen-5-ideは、キノイド構造で描くことができず、双性イオン構造I, IIおよびビラジカル構造IIIの共鳴混成体として記述される。この双性イオンは小さなHOMO–LUMOエネルギー差に起因する近赤外吸収(約1100 nm)や両性の酸化還元特性(ΔEredox = 1.48 eV)を示し、機能性π共役分子の基本骨格として有望である。また、熱励起三重項種の観測およびDFT計算から、この双性イオンの開殻性も明らかにしている[1]。
最近の発表論文
- Arikawa, S.; Shimizu, A.; Shintani, R. Angew. Chem., Int. Ed. 2019, 58, 6415.
5. 基底三重項炭化水素分子の合成と物性
2つの不対電子が強磁性的に相互作用する基底三重項分子は、磁性材料の基本骨格になりうる。これまでに、ニトロキシドなどの安定なラジカルを基盤とする様々な基底三重項の有機分子が合成され、磁気的特性が明らかにされてきた。一方、基底三重項の炭化水素分子は反応性が高く、その研究のほとんどが低温マトリックス中での発生と検出に限られており、これまでに結晶構造が明らかにされたものはなかった。このような研究背景を踏まえ、当研究室では、基底三重項炭化水素分子を安定な形で合成・単離し、磁気的、光学的、電気化学的特性を明らかにする研究を行っている。
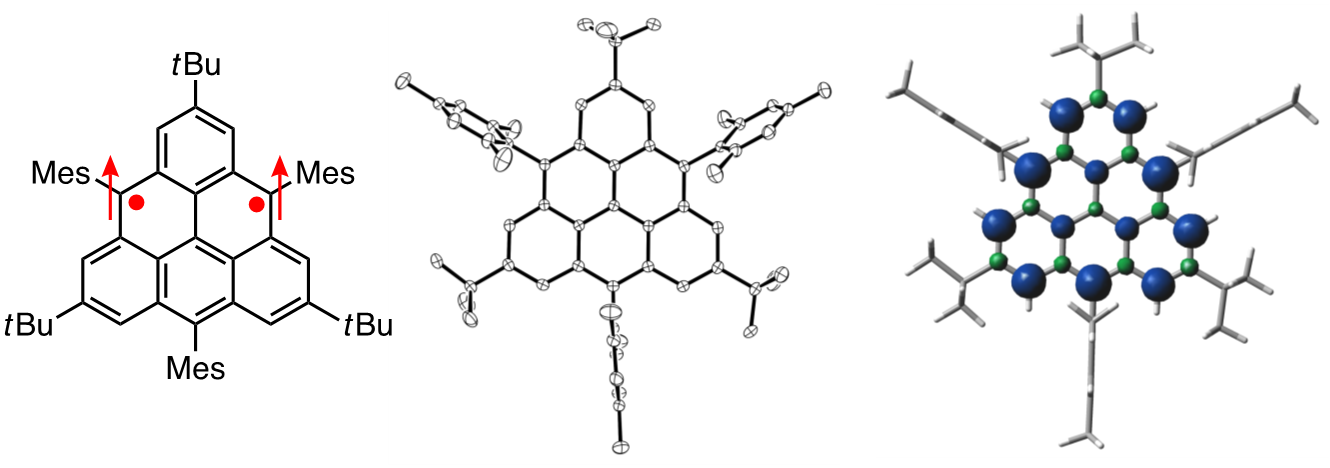
例えば、Clarの炭化水素として知られる、trianguleneは1950年代から合成が検討され、様々な研究グループが合成と単離に挑戦してきたが、誘導体を含め、その単離には成功していなかった。当研究室では、かさ高い置換基を適切な位置に導入することで速度論的に安定化した誘導体を設計し、その合成・単離を行い、結晶構造の解明に成功した[1]。合成したtriangulene誘導体は、高い対称性をもつ基底三重項種であり、2つの不対電子の間に働く相互作用が大きいことを明らかにした。さらに、ジカチオンへの二電子酸化およびジアニオンへの二電子還元が可能であることも見出している。
最近の発表論文
- Arikawa, S.; Shimizu, A.; Shiomi, D.; Sato, K.; Shintani, R. J. Am. Chem. Soc. 2021, 143, 19599.
