- 日本語
- |
- English
カリキュラム
- HOME
- カリキュラム
合成化学コースカリキュラムの特徴
セントラルサイエンスのひとつ「化学」。その基本の4本の柱を徹底的に学ぶ
合成化学コースは英語で表現すると Division of Chemistry。ここで学ぶのは、まさに化学そのものです。現代のサイエンスとテクノロジーを支える化学の基本である「有機化学」「無機化学」「物理化学」「高分子化学」。余分な先端的末節的知識の詰め込み教育はせずにこれらの基礎を系統立てて徹底的に学んでもらう、将来世界中のどこででも、どのような分野ででも通用する人材に育てる高度基礎専門教育を行います。
理論と実験。真の自然観、物質観を育てる充実の実験系科目
教科書を広げた机の上での勉強は、基礎としてとても大切。でもそれだけでは、将来世界の人々や地球のために本当に役立つ仕事をするための、大局的な自然観、物質観は決して養えません。合成化学コースでは、上記基幹科目で学んだ事柄を実際にその目でその手で体感し、文字通り自然を体得させるための実験に多くの時間を割いています「無機・分析化学実験」「合成化学実験(有機化学、高分子化学)」「物理化学実験」等)。これら実験系科目は、多くの教職員、大学院学生が1対1で学生諸君に対応するまさにマスプロ教育の対極を行く個別教育です。
自主性を重んじる教育。特徴ある研究系科目
2年生になって、さっそく自主的研究ができます(「化学研究入門」前期、選択)。その名もProblem-Based Learning。合成化学コースでは米国大学発祥の初年度自主研究の手法を導入。自分でテーマを探してきて、半年間自由に研究して発表するプチ研究で、将来の研究者の芽が育まれていきます。太陽電池を造ったり、DNAを抽出・増幅したり、乾燥しても水で戻せば生き返るクマムシを探したり。先生方が責任を持って見守り指導しますから、やりたいようにやってください。そして4年生になれば、研究室に配属され、「特別研究(卒業研究)」でいよいよ本格的研究の世界に突入です。合成化学の先生方は、いずれも世界ステージで戦う上級研究者。卒業論文のテーマも当然世界的レベルで、研究室教員、大学院生一体の指導体制の中、高度な研究センスが自然に身についていきます。
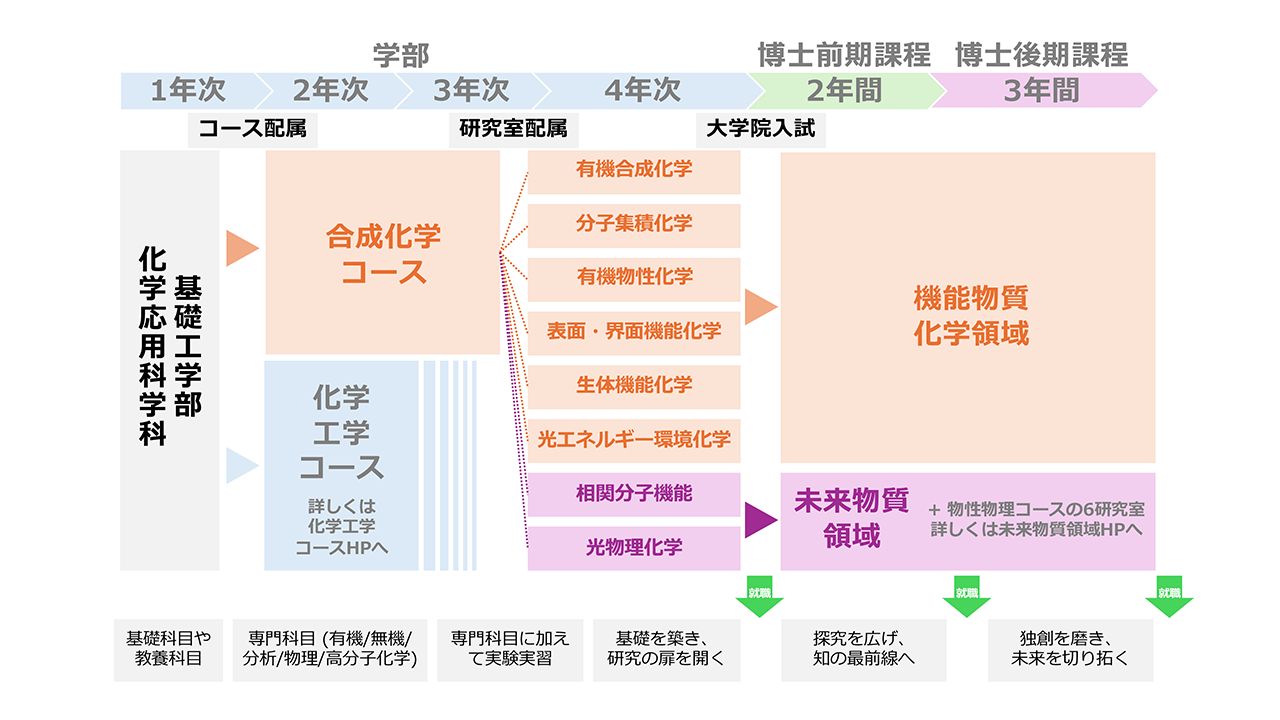
合成化学コースからの大学院進学
合成化学コースを卒業した後関連の深い大学院として基礎工学研究科物質創成専攻の機能物質化学領域と未来物質領域があり、密接に連携して研究をさらに進めることができます。また太陽エネルギー化学研究センターとも連携しています。
機能物質化学領域
新しい機能や優れた性能をもつ物質を創り出す機能物質化学は、化学産業のみならず、情報、エレクトロニクス、医療をはじめとするあらゆる産業分野の発展の物質的基盤を支え、環境問題、エネルギー資源の枯渇など21世紀の人類社会が直面する諸問題の解決を担う基幹的学術分野として、その役割は益々重要になっています。機能物質化学領域では、従来からの「合成化学」講座とともに物性化学の基盤に加えて生体化学を視野に入れた「機能化学」講座を設置し、太陽エネルギー化学研究センターの協力講座とも連携を深め、新規かつ特異な構造の分子系、分子組織系、表面・界面系の創製と、それによる新規物性・高次(インテリジェント)機能の開拓を目指しています。また、これらの研究成果を踏まえて、基礎を重視した教育を行い、化学を必要とする幅広い分野で活躍できる人材育成を行っています。
未来物質領域
21世紀の基盤科学技術創造のためには、物理と化学の学際領域を融合した未来物質の創製と物性探索研究が不可欠です。特にナノマテリアルの世界はまさに物理と化学の学際領域と言えます。本領域では、優れた理論的・実験的枠組みをもつ物性物理学と分子化学の基礎に立脚して、物質中で電子と光が織りなす多様な物性の解明と新現象探索、新物質創製を行いながら、物質科学とその応用のフロンティアーを切り開くことのできる幅広い視野を持った研究者、技術者を育成する教育研究活動を行っています。